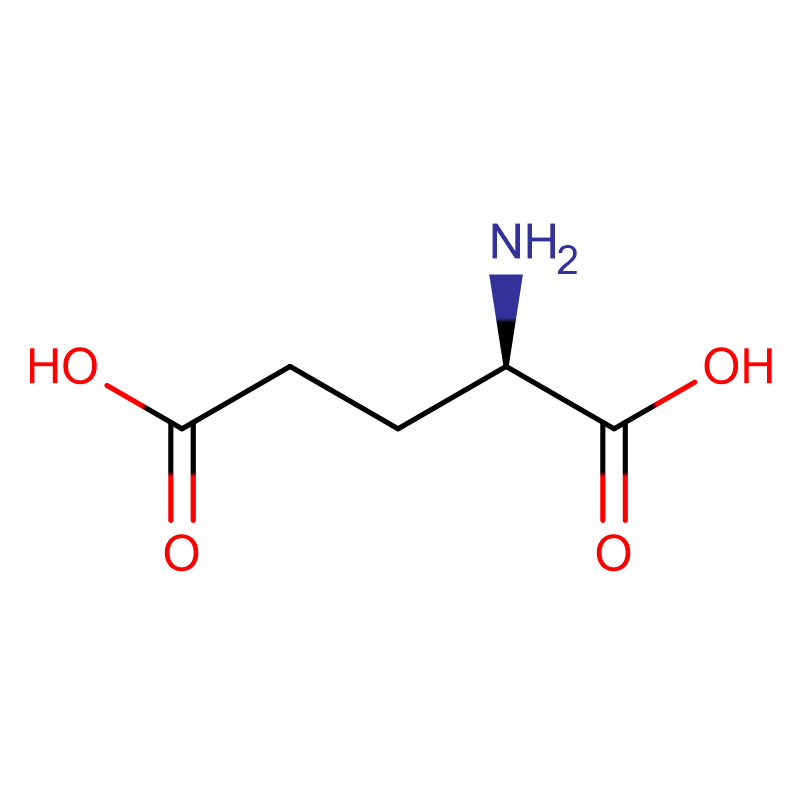
D-glutamo rūgštis CAS:6893-26-1 99% Balti milteliai
| Katalogo numeris | XD90313 |
| produkto pavadinimas | D-glutamo rūgštis |
| CAS | 6893-26-1 |
| Molekulinė formulė | C5H9NO4 |
| Molekulinė masė | 147.13 |
| Išsami informacija apie saugojimą | Aplinka |
| Suderintas tarifų kodeksas | 29224200 |
Produkto Aprašymas
| Išvaizda | Balti kristaliniai milteliai |
| Analizė | 99 % |
| Specifinis sukimasis | -31 iki -32,2 |
| Sunkieji metalai | <10 ppm |
| AS | <1 ppm |
| pH | 3 - 3,5 |
| SO4 | <0,020 % |
| Fe | <10 ppm |
| Praradimas džiovinant | <0,20 % |
| Likučiai užsidegus | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,02 % |
| Sprendimo būsena | >98 % |
γ-glutamiltranspeptidazės (γ-GTs) suskaido glutationo γ-glutamilo amido jungtį ir perkelia išlaisvintą γ-glutamilo grupę į vandenį (hidrolizė) arba akceptorines aminorūgštis (transpeptidacija).Šie visur esantys fermentai atlieka pagrindinį vaidmenį glutationo biosintezėje ir skaidyme bei ksenobiotinėje detoksikacijoje.Čia pateikiame Bacillus licheniformis γ-GT (BlGT) ir jo komplekso su l-Glu 3Å raiškos kristalinę struktūrą.Rentgeno spindulių struktūros patvirtina, kad BlGT priklauso N-galinės nukleofilinės hidrolazės superšeimai ir atskleidžia, kad baltymas turi atvirą aktyviosios vietos plyšį, panašų į tą, kuris buvo praneštas homologiniam fermentui iš Bacillus subtilis, tačiau skiriasi nuo pastebėtų žmogaus γ-GT ir γ-GT iš kitų mikroorganizmų.Duomenys rodo, kad l-Glu surišimas sukelia BlGT didelio subvieneto C-galinės uodegos pertvarkymą ir leidžia identifikuoti rūgščių liekanų grupę, kuri gali būti susijusi su metalo jonų atpažinimu.Šių likučių vaidmuo BlGT konformaciniam stabilumui buvo ištirtas apibūdinant keturių naujų Ala pavienių mutantų automatinį apdorojimą, fermentinį aktyvumą, cheminę ir terminę denatūraciją.Rezultatai rodo, kad Asp568 pakeitimas Ala turi įtakos tiek automatiniam apdorojimui, tiek struktūriniam baltymo stabilumui.